【編者按】2020年11月29日,國(guó)家自然科學(xué)基金委員會(huì)交叉科學(xué)高端學(xué)術(shù)論壇在京召開(kāi)。來(lái)自計(jì)算數(shù)學(xué)、人工智能、生物物理、人因工程、量子計(jì)算、納米生物學(xué)、地磁學(xué)、類(lèi)腦科學(xué)、材料學(xué)等跨學(xué)科交叉研究領(lǐng)域的32位專(zhuān)家學(xué)者出席會(huì)議。與會(huì)專(zhuān)家一致認(rèn)為,學(xué)科交叉融合是未來(lái)科學(xué)發(fā)展的必然趨勢(shì),是加速科技創(chuàng)新的重要驅(qū)動(dòng)力。為進(jìn)一步推動(dòng)交叉學(xué)科繁榮發(fā)展,《中國(guó)科學(xué)基金》編輯部會(huì)同交叉科學(xué)部就本次高端學(xué)術(shù)論壇組約了“交叉科學(xué)前沿與發(fā)展”專(zhuān)題,特邀中國(guó)科協(xié)名譽(yù)主席韓啟德院士、吳家睿研究員、張禮和院士、潘永信院士、杜江峰院士、趙宇亮院士、陳善廣研究員(國(guó)際宇航科學(xué)院院士)、雒建斌院士等專(zhuān)家,分別撰寫(xiě)了專(zhuān)題文章,以饗讀者。
本次推送《中國(guó)科學(xué)基金》2021年第2期“交叉科學(xué)前沿與發(fā)展”專(zhuān)題系列文章之六,趙宇亮院士:“智能納米機(jī)器用于重大疾病治療的研究進(jìn)展”。歡迎廣大讀者轉(zhuǎn)載、推送、引用。
智能納米機(jī)器用于重大疾病治療的研究進(jìn)展
李素萍1,2 陸澤方1,2 聶廣軍1,2 趙宇亮1,2*
1. 國(guó)家納米科學(xué)中心 納米生物效應(yīng)與安全性重點(diǎn)實(shí)驗(yàn)室,北京
2. 中國(guó)科學(xué)院大學(xué) 納米科學(xué)與技術(shù)學(xué)院,北京
趙宇亮 中國(guó)科學(xué)院院士,發(fā)展中國(guó)家科學(xué)院院士,國(guó)家納米科學(xué)中心主任。2001年率先提出納米生物安全性問(wèn)題并創(chuàng)建第一個(gè)實(shí)驗(yàn)室,率先揭示了無(wú)機(jī)和碳納米材料的生物安全性規(guī)律與腫瘤納米藥物的化學(xué)生物學(xué)機(jī)制,部分研究成果已被ISO頒布為國(guó)際標(biāo)準(zhǔn)。曾兩次獲國(guó)家自然科學(xué)獎(jiǎng)二等獎(jiǎng)、中國(guó)科學(xué)院杰出科技成就獎(jiǎng)、何梁何利基金科學(xué)與技術(shù)進(jìn)步獎(jiǎng)、中國(guó)僑界貢獻(xiàn)獎(jiǎng)、TWAS化學(xué)獎(jiǎng)、中國(guó)毒理學(xué)杰出貢獻(xiàn)獎(jiǎng)、全國(guó)優(yōu)秀科技工作者等。創(chuàng)建了中國(guó)藥學(xué)會(huì)“納米藥物”專(zhuān)業(yè)委員會(huì)、中國(guó)毒理學(xué)會(huì)“納米毒理學(xué)”專(zhuān)業(yè)委員會(huì),大力推動(dòng)了納米生物學(xué)交叉前沿在我國(guó)的起步和發(fā)展。此外,在國(guó)外期間與日本同事發(fā)現(xiàn)113號(hào)新元素Nh,是元素周期表中亞洲國(guó)家發(fā)現(xiàn)的唯一的新元素。
李素萍 國(guó)家納米科學(xué)中心研究員,博士生導(dǎo)師。國(guó)家萬(wàn)人計(jì)劃“青年拔尖”,北京市杰出青年科學(xué)基金獲得者。以第一作者或通訊作者在Nature Biotechnology、Nature Biomedical Engineering、Nano Letters、Advanced Materials等期刊發(fā)表多篇論文;獲授權(quán)發(fā)明專(zhuān)利7項(xiàng)(專(zhuān)利轉(zhuǎn)化2項(xiàng));主持國(guó)家重點(diǎn)研發(fā)計(jì)劃、國(guó)家自然科學(xué)基金重大研究計(jì)劃—培育項(xiàng)目、中國(guó)科學(xué)院創(chuàng)新交叉團(tuán)隊(duì)項(xiàng)目等。成果入選2018年中國(guó)科學(xué)十大進(jìn)展,入選美國(guó)The Scientist 2018 “Top Technical Advances”。
摘 要
我國(guó)重大疾病的發(fā)生率和致死率居高不下,隨著老年社會(huì)程度的不斷加深,需要更強(qiáng)有力的醫(yī)藥原始創(chuàng)新動(dòng)力支撐不斷增長(zhǎng)的醫(yī)學(xué)需求。醫(yī)用納米技術(shù)作為新興的疾病預(yù)防、檢測(cè)、成像和治療技術(shù),將是未來(lái)醫(yī)療體系的重要組成部分。目前我國(guó)在納米藥物治療重大疾病(如腫瘤、血栓性疾病等)和藥物遞送領(lǐng)域的基礎(chǔ)研究已經(jīng)處于世界前列。其中,用于疾病治療的智能納米機(jī)器作為一個(gè)新興的交叉科學(xué),可實(shí)現(xiàn)藥物在病灶部位的精準(zhǔn)可控釋放,未來(lái)有可能成為藥物研發(fā)中的變革性力量。但是,智能納米機(jī)器在藥物智能化設(shè)計(jì)、體內(nèi)外精準(zhǔn)操控、體內(nèi)代謝行為和生物效應(yīng)評(píng)價(jià)以及臨床轉(zhuǎn)化等方面還有待進(jìn)一步的突破。需要從基礎(chǔ)研究和應(yīng)用技術(shù)兩個(gè)方面,為學(xué)科領(lǐng)域的進(jìn)一步快速發(fā)展和臨床轉(zhuǎn)化應(yīng)用創(chuàng)造條件。本文從國(guó)家戰(zhàn)略需求出發(fā),討論了智能納米機(jī)器的設(shè)計(jì)原則與發(fā)展趨勢(shì),根據(jù)基礎(chǔ)和應(yīng)用兩方面面臨的挑戰(zhàn),分析了智能納米機(jī)器研究中的關(guān)鍵科學(xué)問(wèn)題和未來(lái)發(fā)展方向,并提出一些建議和發(fā)展目標(biāo),以加速我國(guó)智能納米機(jī)器藥物的研究和商業(yè)化進(jìn)程。
關(guān)鍵詞:智能納米機(jī)器;藥物遞送;精準(zhǔn)醫(yī)學(xué);臨床轉(zhuǎn)化;交叉科學(xué)
1 醫(yī)用納米技術(shù)的戰(zhàn)略意義
近年來(lái)我國(guó)的醫(yī)療水平不斷提升,人口壽命不斷延長(zhǎng)。2000至2015年,我國(guó)人口平均預(yù)期壽命由71.40歲上升至76.34歲,但與之伴隨的則是人口的深度老齡化,2019年,65歲及以上人口突破12%,是世界上人口老齡化速度最快的國(guó)家之一[1]。人口老齡化不僅沖擊經(jīng)濟(jì)建設(shè)和社會(huì)福利保障體系,同時(shí)也給醫(yī)療結(jié)構(gòu)帶來(lái)新的挑戰(zhàn)。1990—2017年,我國(guó)傳染病和新生兒疾病致死率大幅降低,疾病譜轉(zhuǎn)變?yōu)橐孕哪X血管疾病、惡性腫瘤為代表的非傳染性疾病[2];同時(shí),全社會(huì)對(duì)疾病預(yù)防、檢測(cè)、成像和治療提出新的要求。然而,目前我國(guó)的重大疾病藥物和高端醫(yī)療器械高度依賴(lài)于進(jìn)口,造成嚴(yán)重的醫(yī)療負(fù)擔(dān)。特別是新型冠狀病毒全球大流行,更是將應(yīng)急反應(yīng)和傳染病防控能力,包括疫苗研發(fā)和新藥研發(fā)能力推至全球的焦點(diǎn)。2020年9月,習(xí)近平總書(shū)記在《求是》雜志發(fā)表重要文章強(qiáng)調(diào) “集中力量開(kāi)展核心技術(shù)攻關(guān),持續(xù)加大重大疫病防治經(jīng)費(fèi)投入,加快補(bǔ)齊我國(guó)在生命科學(xué)、生物技術(shù)、醫(yī)藥衛(wèi)生、醫(yī)療設(shè)備等領(lǐng)域的短板”,將生命安全和生物安全領(lǐng)域的重大科技成果提升到國(guó)之重器層面。因此,我國(guó)亟需進(jìn)一步加強(qiáng)藥物原始創(chuàng)新能力,促進(jìn)由仿制藥到原研藥的轉(zhuǎn)變,同時(shí)進(jìn)一步在關(guān)鍵醫(yī)藥創(chuàng)新領(lǐng)域加強(qiáng)原始創(chuàng)新能力,減輕國(guó)家醫(yī)療負(fù)擔(dān),維護(hù)國(guó)家生物安全。
在新藥研發(fā)中,除了在新機(jī)制、新靶點(diǎn)和新型藥物分子的激烈競(jìng)爭(zhēng)外,藥物遞送貫穿新藥研發(fā)的始終,成為世界各大制藥公司競(jìng)爭(zhēng)的熱點(diǎn)和前沿[2]。通過(guò)前藥策略、聚乙二醇(PEG)化以及抗體藥物偶聯(lián)等方式,可以改善部分藥物的水溶性、體內(nèi)分布及代謝動(dòng)力學(xué)性質(zhì),但對(duì)于惡性腫瘤和心腦血管等復(fù)雜病理環(huán)境,需要藥物克服長(zhǎng)循環(huán)難題,跨越多道生理病理屏障,滲透至栓塞或腫瘤組織深處,發(fā)揮溶栓與血管保護(hù)、腫瘤殺傷與免疫激活等多種協(xié)同作用;而單一的對(duì)藥物分子進(jìn)行改造或修飾的策略不足以滿(mǎn)足此類(lèi)需求。
納米載體和/或納米藥物,作為創(chuàng)新型的藥物制劑的重要形式,本身具有獨(dú)特的器官靶向和循環(huán)性質(zhì),通過(guò)集成創(chuàng)新,實(shí)現(xiàn)多種藥物的共負(fù)載、靶向遞送和可控釋放。在眾多臨床疾病中,惡性腫瘤病理微環(huán)境復(fù)雜、治療難度高,是納米藥物研究的重要內(nèi)容。自1995年第一款納米藥物—阿霉素脂質(zhì)體Doxil被FDA批準(zhǔn)以來(lái),進(jìn)入臨床的傳統(tǒng)抗腫瘤納米藥物大體經(jīng)歷了兩個(gè)代際的發(fā)展。第一代納米藥物主要包括Doxil等以脂質(zhì)體為主要載體的納米藥物,載帶小分子化療藥物,通過(guò)腫瘤血管自身高滲透和滯留效應(yīng)(Enhanced Penetration and Retention, EPR)使納米藥物被動(dòng)富集到腫瘤組織,降低化藥的毒副作用;第二代納米藥物Abraxane和Genexol-PM等主要利用膠束、白蛋白等生物相容性好的分子作為材料合成納米載體,載帶的藥物類(lèi)型除了包括化療藥物之外,還有核酸、多肽和蛋白類(lèi)藥物,同時(shí)對(duì)載體表面進(jìn)行PEG修飾延長(zhǎng)血液循環(huán)時(shí)間,用于腫瘤的基因治療、免疫治療以及聯(lián)合治療等。還包括ThermoDox、BIND-014等在納米載體中引入主動(dòng)尋靶和環(huán)境響應(yīng)性分子單元,以實(shí)現(xiàn)藥物的主動(dòng)靶向和可控釋放,以及一些無(wú)機(jī)納米材料為代表的其它應(yīng)用。而近幾年興起的第三代納米藥物是智能化的時(shí)代,我們概括地稱(chēng)之為智能納米機(jī)器。廣義上說(shuō)包含了臨床前研究中的外泌體(exosome)、細(xì)胞膜、細(xì)菌外膜囊泡、微顆粒等天然材料,以及DNA框架自組裝、DNA折紙等精準(zhǔn)可控載體合成技術(shù)制備的納米機(jī)器藥物[3-8],以實(shí)現(xiàn)多種致病因素的共消除和疾病微環(huán)境的有效調(diào)控。這些具備環(huán)境響應(yīng)性、病灶主動(dòng)識(shí)別和特異性響應(yīng)特征的納米藥物已初具智能納米機(jī)器的雛形,不僅能改善傳統(tǒng)納米藥物的療效與安全性平衡的挑戰(zhàn),同時(shí)也為包括mRNA藥物和疫苗、基因編輯、干細(xì)胞治療和個(gè)性化腫瘤疫苗等新興技術(shù)的體內(nèi)應(yīng)用奠定了廣泛的科學(xué)和技術(shù)基礎(chǔ),具有較強(qiáng)的臨床應(yīng)用價(jià)值和前景。
早期納米藥物臨床實(shí)踐與當(dāng)前不斷涌現(xiàn)的智能納米機(jī)器研究都表明,以臨床需求為導(dǎo)向,研究納米藥物的精準(zhǔn)組裝、智能響應(yīng)、體內(nèi)生物學(xué)效應(yīng)、生物安全性等內(nèi)容,促進(jìn)納米藥物的臨床轉(zhuǎn)化,對(duì)于提升我國(guó)的醫(yī)療水平、維護(hù)國(guó)家生物安全具有重要意義。通過(guò)多學(xué)科深度交叉,“產(chǎn)學(xué)研醫(yī)藥”結(jié)合,醫(yī)用納米技術(shù)將為一系列“卡脖子”技術(shù)提供解決方案,是我國(guó)實(shí)現(xiàn)重大技術(shù)趕超的重要機(jī)遇。
2 第三代納米藥物——醫(yī)用智能納米機(jī)器的設(shè)計(jì)原則和發(fā)展趨勢(shì)
納米技術(shù)廣泛地滲透到疾病預(yù)防、檢測(cè)、成像、治療的方方面面,例如納米孔用于長(zhǎng)程核酸測(cè)序以早期檢測(cè)疾病相關(guān)的DNA甲基化,微流控芯片/生物條碼使用少量樣品即可檢測(cè)多個(gè)疾病標(biāo)志物,量子點(diǎn)、微囊泡和Fe3O4納米顆粒增強(qiáng)光學(xué)、超聲與核磁成像等[9-11]。在治療方面,微針貼片局部透皮給藥可以解決長(zhǎng)效緩釋問(wèn)題,同時(shí)提供了一種全新的無(wú)痛給藥與體液抽取方式,入選世界經(jīng)濟(jì)論壇和《科學(xué)美國(guó)人》共同評(píng)選出的2020年十大新興技術(shù)進(jìn)步。
然而由于生物體內(nèi)的復(fù)雜性,藥物如何到達(dá)病灶部位并發(fā)揮預(yù)期效果是更大的挑戰(zhàn)。智能納米機(jī)器為解決這一挑戰(zhàn)提供可能:理想的納米藥物載體應(yīng)當(dāng)可以在體內(nèi)長(zhǎng)循環(huán),自發(fā)或在引導(dǎo)下到達(dá)病灶區(qū),精準(zhǔn)識(shí)別細(xì)胞或病原體上的疾病特異性標(biāo)志物,針對(duì)不同的病理環(huán)境釋放對(duì)應(yīng)的報(bào)告分子與藥物,我們形象的稱(chēng)其為“納米機(jī)器人”。
利用智能納米機(jī)器人治療疾病是人類(lèi)長(zhǎng)久以來(lái)的美好愿望。1959年諾貝爾獎(jiǎng)得主理查德·費(fèi)曼曾暢想“吞下外科醫(yī)生”(即納米尺度的微型智能機(jī)器人);28年后在科幻電影《驚異大奇航》中展示了人類(lèi)乘坐微納機(jī)器人進(jìn)入體內(nèi)的奇幻場(chǎng)景,獲得奧斯卡最佳視覺(jué)效果獎(jiǎng)。在實(shí)際應(yīng)用中,納米機(jī)器人應(yīng)當(dāng)包含四個(gè)(或更多)基礎(chǔ)模塊:靶向模塊、載藥模塊、響應(yīng)模塊和動(dòng)力模塊(圖1)。靶向模塊是納米機(jī)器的天線(xiàn),可由抗體片段、多肽、核酸適配體和葉酸等小分子組成,介導(dǎo)納米載體在病灶區(qū)的主動(dòng)聚集和與靶細(xì)胞的結(jié)合。對(duì)于需要穿過(guò)多道生理病理屏障的納米機(jī)器(如治療腦部疾病和用于口服藥物遞送,需要穿過(guò)血腦屏障和腸粘膜屏障),可以修飾多個(gè)靶向配體以實(shí)現(xiàn)多級(jí)跨屏障遞送。載藥模塊是納米機(jī)器的艙室,納米載體通過(guò)主客體相互作用、親疏水相互作用、靜電吸附、物理包埋、化學(xué)偶聯(lián)和配位交聯(lián)等方式將貨物分子載帶至顆粒內(nèi)部或表面,通過(guò)富集藥物的方式,增加藥物療效同時(shí)減少毒副作用。響應(yīng)模塊是納米機(jī)器的CPU,針對(duì)疾病相關(guān)特異性升高的生物標(biāo)志物,疾病微環(huán)境中酸/堿、氧化/還原、酶、乏氧、血流剪切力等理化特征,外部施加的光、聲、熱、電、磁信號(hào),以及內(nèi)部裝載貨物引起的酶、活性氧、氫離子和特定序列核酸濃度的變化,通過(guò)一系列分子鎖與邏輯運(yùn)算實(shí)現(xiàn)納米載體變構(gòu)和貨物的可控可逆釋放。動(dòng)力模塊是納米機(jī)器的能源,可以將外界施加的光能、聲能、磁能和體內(nèi)的生物能轉(zhuǎn)化為納米載體定向運(yùn)動(dòng)的動(dòng)能,在目標(biāo)區(qū)域克服血液流動(dòng)對(duì)納米載體的沖擊,增加載體在靜止細(xì)胞間液或致密胞外基質(zhì)中對(duì)病灶深處的滲透。
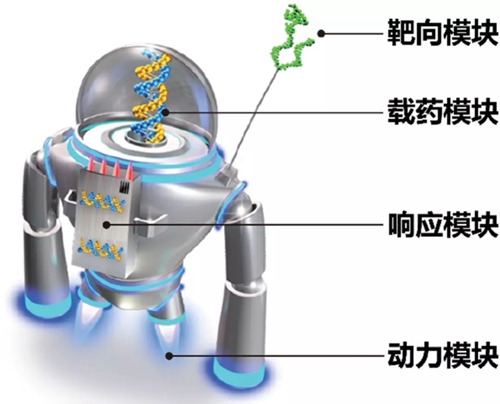
圖1 智能納米機(jī)器人的設(shè)計(jì)構(gòu)想
由于納米機(jī)器人的復(fù)雜性與前瞻性,在臨床試驗(yàn)中尚未有納米機(jī)器人成功應(yīng)用的報(bào)道。在臨床前研究中,納米機(jī)器人藥物的設(shè)計(jì)可分為三類(lèi):(1) 自下而上的分子自組裝,根據(jù)病灶微環(huán)境特性設(shè)計(jì)生物響應(yīng)性載體;(2) 自上而下的生物信息利用,直接使用或功能改造生物來(lái)源的、具有特定功能的天然納米機(jī)器,例如蛋白復(fù)合物或納米囊泡載藥;(3) 二者結(jié)合,整合合成納米載體與生物載體的優(yōu)勢(shì),構(gòu)建復(fù)合載體。
分子自組裝更側(cè)重于材料學(xué)和化學(xué)基礎(chǔ),根據(jù)疾病與治療相關(guān)的內(nèi)外源刺激,一一對(duì)應(yīng)功能模塊,如可斷裂敏感鍵、電荷反轉(zhuǎn)、可脫離/降解殼層等,實(shí)現(xiàn)對(duì)納米機(jī)器的時(shí)空控制(圖2a)。聚合物分子有大量可供反應(yīng)的活性基團(tuán),在單體聚合前后都可以連接小分子藥物,引入敏感與靶向模塊,實(shí)現(xiàn)病灶特異性富集以及pH響應(yīng)、谷胱甘肽響應(yīng)、活性氧響應(yīng)、溫度響應(yīng)和乏氧響應(yīng)等功能,通過(guò)調(diào)節(jié)親疏水比例以形成納米結(jié)構(gòu)(圖2b)。與聚合物類(lèi)似,多肽也是在分子合成過(guò)程中引入功能模塊,通過(guò)親疏水相互作用/氫鍵形成納米球或納米纖維,在血液循環(huán)中保護(hù)藥物免受血漿蛋白的干擾(圖2c)。不同的是多肽序列本身就可以發(fā)揮靶向、酸響應(yīng)、酶響應(yīng)和藥理功能,合成與修飾工藝也更加成熟,故而更適合大規(guī)模制備。除分子級(jí)別的自組裝外,力學(xué)、化學(xué)與光學(xué)刺激下的納米顆粒二次組裝與解組裝,在血栓或腫瘤部位實(shí)現(xiàn)粒徑變化,對(duì)于增加藥物在病灶區(qū)域的滯留有重要意義(圖2d)。DNA折紙納米載體的出現(xiàn)將疾病相關(guān)的蛋白標(biāo)志物水平升高納入刺激因素,部分互補(bǔ)配對(duì)的核酸適配體與其靶向蛋白或小分子結(jié)合后,與互補(bǔ)鏈解離打開(kāi)分子鎖,引起折紙結(jié)構(gòu)構(gòu)象改變,暴露或釋放內(nèi)部藥物;通過(guò)精準(zhǔn)控制核酸適配體單鏈、分子鎖的數(shù)量和位置,可以設(shè)計(jì)多個(gè)標(biāo)志物的濃度限以及響應(yīng)間的邏輯關(guān)系,從而更加精確的識(shí)別靶細(xì)胞;在內(nèi)部裝載特定核酸序列,與分子鎖進(jìn)行鏈置換或鏈交聯(lián),可實(shí)現(xiàn)藥物釋放的正負(fù)反饋,釋放可控可逆更加貼近納米機(jī)器的理念,目前已初步驗(yàn)證DNA納米機(jī)器的體內(nèi)應(yīng)用,以腫瘤血管內(nèi)皮表面特異性上調(diào)的核仁素受體為靶標(biāo)和刺激,控制DNA納米機(jī)器暴露凝血酶堵塞腫瘤血管(圖2e)[8]。然而DNA納米機(jī)器在增加核酸體內(nèi)穩(wěn)定性、拓寬核酸適配體文庫(kù)、降低合成成本以及設(shè)計(jì)具有完整邏輯電路的多合一納米機(jī)器等方面還需進(jìn)一步完善。最后,對(duì)于可以響應(yīng)外部刺激,如光、聲、磁信號(hào),報(bào)告納米機(jī)器位置或狀態(tài)的類(lèi)型,其特殊意義在于圖像引導(dǎo)下的病灶局部納米機(jī)器變構(gòu)或響應(yīng),釋放、暴露內(nèi)含物,或者利用納米材料本身的性質(zhì)產(chǎn)生聲、熱以及自由基殺傷,同時(shí)監(jiān)測(cè)治療進(jìn)程,可視化納米機(jī)器的體內(nèi)分布與代謝動(dòng)力學(xué)行為,為銜接后續(xù)療法提供更為精確的治療窗口。但是,這類(lèi)納米機(jī)器需要綜合考慮外界刺激的作用類(lèi)型、可及深度、分辨率以及能夠響應(yīng)這些刺激的納米材料的短期和長(zhǎng)期毒性,在疾病類(lèi)型的選擇上有較高的挑戰(zhàn)。
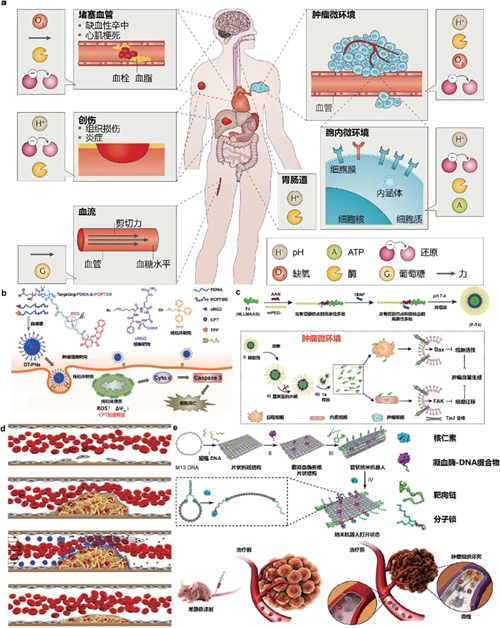
圖2 自下而上的分子自組裝納米機(jī)器在疾病治療中的應(yīng)用
(a) 疾病微環(huán)境和生物體內(nèi)的刺激響應(yīng)要素[12];(b) 用于腫瘤光動(dòng)力治療的二級(jí)靶向聚合物膠束納米機(jī)器[13];(c) 用于抗腫瘤血管新生治療的多肽自組裝納米機(jī)器[14];(d) 用于溶栓治療的顆粒二次組裝納米機(jī)器[15];(e) 用于腫瘤血管栓塞治療的DNA納米機(jī)器[8]
自下而上的自組裝納米機(jī)器優(yōu)勢(shì)在于明確遞送過(guò)程中的困難并針對(duì)性開(kāi)展設(shè)計(jì);伴隨著對(duì)疾病病理了解的進(jìn)一步提升,模塊化的納米機(jī)器可以快速調(diào)整合成策略并有望發(fā)展為平臺(tái)技術(shù)。但是這種問(wèn)題與解決方案一一對(duì)應(yīng)的策略也限制了藥物遞送效率;即由于每一模塊的靶向或響應(yīng)效率都不可能達(dá)到100%,引入的模塊越多,其按照設(shè)計(jì)執(zhí)行功能的可能性越低。一方面,需要加強(qiáng)對(duì)納米結(jié)構(gòu)構(gòu)效關(guān)系的基礎(chǔ)研究,取得在限制遞送效率關(guān)鍵問(wèn)題上的突破;另一方面,納米機(jī)器的設(shè)計(jì)需要向細(xì)胞生命過(guò)程中的各個(gè)環(huán)節(jié)學(xué)習(xí)。在分子層面上,天然納米機(jī)器有在微絲、微管上運(yùn)輸物質(zhì)的馬達(dá)蛋白,在亞細(xì)胞層面上有翻譯蛋白的核糖體和運(yùn)輸化學(xué)介質(zhì)的胞外囊泡等,除了在分子生物學(xué)上理解天然納米機(jī)器的工作原理以幫助人工設(shè)計(jì),直接利用天然納米結(jié)構(gòu)遞送藥物也是一個(gè)主要發(fā)展方向。天然蛋白質(zhì)可由真核/原核系統(tǒng)表達(dá)大規(guī)模生產(chǎn),其疏水空腔可用于裝載小分子藥物(圖3a)。由于體內(nèi)本身存在這些蛋白,因此可能的免疫原性較低,同時(shí)利用蛋白與其配體的相互作用以及pH、ATP引起的蛋白變構(gòu),可實(shí)現(xiàn)靶向和響應(yīng)功能,是最小的醫(yī)用納米機(jī)器人[16, 17]。蛋白納米機(jī)器人由于空腔尺寸限制,對(duì)大分子藥物的包載難度較大,而內(nèi)涵體胞吐出的外泌體和由質(zhì)膜脫落的微顆粒可通過(guò)電穿孔或基因工程等方式攜載藥物。由于胞外囊泡攜帶細(xì)胞生物信息,介導(dǎo)與特定細(xì)胞類(lèi)型相互作用,因此它也是良好的天然智能納米機(jī)器的代表類(lèi)型(圖3b)。目前許多大型制藥企業(yè)已關(guān)注到胞外囊泡遞送核酸藥物的潛力,僅在2020年6月就發(fā)生了超過(guò)10億美元的外泌體藥物載體相關(guān)交易[18]。此外,細(xì)胞和細(xì)菌膜與其生理效應(yīng)息息相關(guān),提取膜結(jié)構(gòu)并用合成納米顆粒作為支撐,發(fā)揮藥物遞送、免疫刺激和毒素清除的作用,為納米機(jī)器模擬細(xì)胞功能提供了新思路(圖3c)。
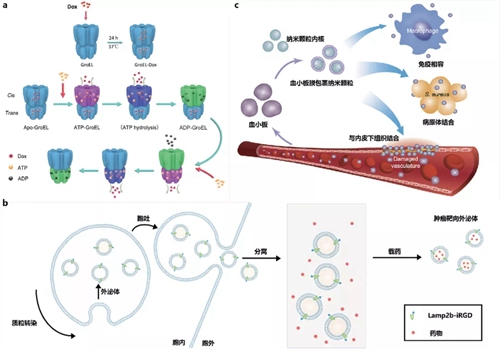
圖3 自上而下的天然載藥納米機(jī)器人
(a) ATP響應(yīng)的天然蛋白質(zhì)納米機(jī)器遞送化療藥物用于腫瘤治療[17];(b) 以外泌體為代表的胞外囊泡納米機(jī)器用于藥物遞送;(c) 血小板膜包裹的納米機(jī)器清除病原體[4]
囊泡或膜包被納米機(jī)器的制備過(guò)程中,磷脂和蛋白成分的改變可能降低藥物遞送效率和藥理作用;另一方面,這類(lèi)納米機(jī)器往往缺乏響應(yīng)模塊,無(wú)法實(shí)現(xiàn)藥物的可控釋放。因此,將自下而上和自上而下的兩種策略結(jié)合,可以最大化的發(fā)揮各自的優(yōu)勢(shì)。一種簡(jiǎn)單的策略是將刺激響應(yīng)性磷脂與天然膜結(jié)構(gòu)融合組裝納米機(jī)器,充分整合各自的響應(yīng)和靶向優(yōu)勢(shì);另一種相對(duì)復(fù)雜的策略是將納米機(jī)器負(fù)載在細(xì)胞或細(xì)菌表面。當(dāng)前的納米載體的病灶特異性富集仍依賴(lài)于被動(dòng)捕獲,即通過(guò)尺寸效應(yīng)和蛋白間相互作用使納米載體停留在病灶區(qū),少數(shù)研究利用酶促、化學(xué)以及超聲空化產(chǎn)生氣泡推進(jìn)納米載體增加在病灶部位的滲透深度,但這些策略存在運(yùn)動(dòng)方向無(wú)法控制、運(yùn)動(dòng)時(shí)間持續(xù)較短等問(wèn)題,即使利用磁場(chǎng)控制納米載體的定向移動(dòng)也受到磁場(chǎng)精度的限制。因此,納米機(jī)器尚不能像細(xì)胞一樣,利用趨向因子濃度梯度主動(dòng)向病灶區(qū)富集。將納米顆粒負(fù)載在細(xì)胞或細(xì)菌表面,由細(xì)胞/細(xì)菌提供靶向和動(dòng)力,納米顆粒提供藥物包載和靈敏響應(yīng),如趨磁細(xì)菌沿磁感線(xiàn)和氧氣梯度向乏氧區(qū)域移動(dòng)攜帶納米顆粒至腫瘤核心[19],T細(xì)胞表面納米顆粒響應(yīng)T細(xì)胞受體激活引起的細(xì)胞表面巰基水平升高, 釋放藥物增強(qiáng)或抑制免疫[20, 21],此類(lèi)研究為目前實(shí)現(xiàn)治療型納米機(jī)器人的四大功能提供了重要參考。不過(guò)這一策略也面臨負(fù)載納米顆粒對(duì)細(xì)胞/細(xì)菌的影響,微米級(jí)細(xì)胞/細(xì)菌在組織內(nèi)滲透,對(duì)納米顆粒的早期內(nèi)吞以及免疫原性等問(wèn)題。未來(lái)隨著對(duì)材料學(xué)、生物學(xué)、生理和病理學(xué)理解的進(jìn)一步深入,模擬或使用天然的感應(yīng)器與效應(yīng)器設(shè)計(jì)醫(yī)用納米機(jī)器人,可實(shí)現(xiàn)自上而下與自下而上的統(tǒng)一。
3 智能納米機(jī)器藥物研究的關(guān)鍵挑戰(zhàn)和瓶頸問(wèn)題
智能納米機(jī)器是多學(xué)科交叉的產(chǎn)物,既有大量的多學(xué)科的基礎(chǔ)研究問(wèn)題,又有巨大的臨床需求為導(dǎo)向的技術(shù)挑戰(zhàn)。因此,從基礎(chǔ)和應(yīng)用兩方面,智能納米機(jī)器的研究需要突破幾個(gè)重要的評(píng)價(jià)和挑戰(zhàn)。
3.1 醫(yī)用納米機(jī)器基礎(chǔ)研究中的關(guān)鍵科學(xué)問(wèn)題
盡管目前已有各種智能納米機(jī)器的設(shè)計(jì),但納米機(jī)器的生物效應(yīng)和構(gòu)效關(guān)系方面的研究仍不夠深入。安全性是藥物使用的前提,因此醫(yī)用納米機(jī)器的生物效應(yīng),尤其是毒理的研究是醫(yī)用納米材料的應(yīng)用基礎(chǔ)。在健康和疾病動(dòng)物模型水平,用多種方式標(biāo)記和檢測(cè)納米機(jī)器及其降解產(chǎn)物的吸收、分布、代謝和排泄,詳細(xì)繪制納米機(jī)器從進(jìn)入到排出活體的時(shí)空分布;在組織層面,除了傳統(tǒng)的病理切片,用質(zhì)譜流式和單細(xì)胞多組學(xué)等新興技術(shù)細(xì)致地描繪細(xì)胞類(lèi)型分布以及受影響的信號(hào)通路;在細(xì)胞水平,充分研究納米機(jī)器的內(nèi)吞途徑以及對(duì)炎癥通路、程序性死亡和功能調(diào)節(jié)通路的影響。該系列問(wèn)題的深入研究,不僅是醫(yī)用納米機(jī)器臨床前研究的必要環(huán)節(jié),也是評(píng)價(jià)環(huán)境及商品中存在納米材料生物安全性的重要方法。
體內(nèi)外納米機(jī)器的表征手段尚不完善,即納米機(jī)器的理化性質(zhì),包括材料、粒徑、電荷、形狀、比表面積、硬度、可變形性、表面配體修飾類(lèi)型與密度對(duì)于顆粒表面蛋白冠的形成、單核吞噬細(xì)胞系統(tǒng)的清除、體內(nèi)分布代謝、病灶區(qū)的富集滯留以及靶細(xì)胞的內(nèi)吞方式的影響,這些未知的問(wèn)題阻礙了不同構(gòu)筑策略間的橫向比較和對(duì)納米機(jī)器發(fā)展路線(xiàn)的進(jìn)一步挖掘。因此,逐步建立一套醫(yī)用納米機(jī)器構(gòu)效關(guān)系的評(píng)價(jià)體系具有重要意義,在此基礎(chǔ)上構(gòu)建數(shù)據(jù)庫(kù),計(jì)算機(jī)學(xué)習(xí)并預(yù)測(cè)新設(shè)計(jì)的納米機(jī)器的遞送效率,可極大地推進(jìn)智能納米機(jī)器的發(fā)展進(jìn)程。
3.2 智能納米機(jī)器應(yīng)用研究中的關(guān)鍵技術(shù)挑戰(zhàn)
智能納米機(jī)器的應(yīng)用研究是利用現(xiàn)有的材料、生物技術(shù),針對(duì)臨床實(shí)踐中的具體需求,結(jié)合藥物作用位點(diǎn)、給藥方式,設(shè)計(jì)精巧實(shí)用和巧妙的納米載體。工業(yè)生產(chǎn)與實(shí)驗(yàn)室小體系合成的動(dòng)量、熱量和質(zhì)量傳遞都不同,擴(kuò)大體系過(guò)程中會(huì)面臨未知的風(fēng)險(xiǎn);同時(shí),臨床應(yīng)用對(duì)納米藥物的均一性和批次間穩(wěn)定性提出了更高的要求,因此納米機(jī)器的設(shè)計(jì)需要在功能性和復(fù)雜性?xún)煞矫孀骱闷胶猓Y選更合適的適應(yīng)癥和患者是智能納米機(jī)器轉(zhuǎn)化過(guò)程中的關(guān)鍵問(wèn)題。
4 加速智能納米藥物領(lǐng)域發(fā)展的若干思考
目前納米藥物領(lǐng)域發(fā)表的納米遞藥相關(guān)研究成果中,50%以上屬于抗腫瘤治療領(lǐng)域。這可能是由于腫瘤的廣泛性與嚴(yán)重性、抗腫瘤藥物的龐大市場(chǎng)、臨床上抗腫瘤納米藥物的廣泛應(yīng)用、人們對(duì)腫瘤細(xì)胞及其微環(huán)境了解的深入以及相對(duì)成熟的抗腫瘤納米藥物生物學(xué)評(píng)價(jià)體系。但是,納米藥物從進(jìn)入血管到被腫瘤微環(huán)境中的細(xì)胞吞噬面臨多道限速步驟,需要設(shè)計(jì)構(gòu)建多功能的納米機(jī)器。相對(duì)而言,適合用納米機(jī)器治療的疾病應(yīng)當(dāng)具有如下特征:
(1)與臨床上的標(biāo)準(zhǔn)治療方案相比,通過(guò)納米遞送的方式可以增加藥物在病灶區(qū)的富集或改變給藥方式減輕病人痛苦,增加依從性;
(2)藥物起效部位應(yīng)當(dāng)易于到達(dá),如對(duì)于靜脈輸注的納米機(jī)器,血管內(nèi)起效藥物優(yōu)于胞外起效優(yōu)于胞內(nèi)起效;
(3)與周?chē)=M織相比,病灶區(qū)有較為明顯的生化性質(zhì)改變;
(4)已存在有潛力的治療方案但缺乏體內(nèi)應(yīng)用遞送載體。這些疾病的給藥方式并不全都是靜脈輸注;因此,研究經(jīng)鼻、口服、滴眼納米藥物到達(dá)病灶區(qū)的特殊屏障,并與臨床需求緊密結(jié)合明確適應(yīng)癥,探索治療的可行性,可以拓寬納米藥物的適用范圍,加速臨床轉(zhuǎn)化。
精準(zhǔn)給藥是病人用藥的大趨勢(shì)。在治療前檢測(cè)病人體內(nèi)的標(biāo)志物,對(duì)于選擇合適的治療方案至關(guān)重要。由于影響納米機(jī)器體內(nèi)遞送的因素眾多,因此納米機(jī)器的配套檢測(cè)手段不能僅僅以生物標(biāo)志物作為指標(biāo)。一個(gè)思路是設(shè)計(jì)與載藥納米機(jī)器結(jié)構(gòu)相同、攜帶報(bào)告分子的空載體,當(dāng)納米機(jī)器打開(kāi)時(shí)報(bào)告分子激活發(fā)出信號(hào),可視化納米機(jī)器的體內(nèi)運(yùn)行情況,據(jù)此對(duì)病人進(jìn)行分級(jí),可能增加納米藥物臨床試驗(yàn)的成功率。
5 促進(jìn)醫(yī)用納米技術(shù)行業(yè)發(fā)展的若干建議
智能納米機(jī)器藥物是高度交叉的多學(xué)科融合的領(lǐng)域。結(jié)合臨床實(shí)踐和交叉學(xué)科發(fā)展的內(nèi)在動(dòng)因,促進(jìn)醫(yī)用納米技術(shù)的基礎(chǔ)研究與臨床應(yīng)用更好地結(jié)合,在未來(lái)形成我國(guó)在醫(yī)藥衛(wèi)生領(lǐng)域的關(guān)鍵核心技術(shù)體系。
(1)進(jìn)一步促進(jìn)多學(xué)科交叉融合。智能納米機(jī)器作為未來(lái)醫(yī)療的重要組成部分,應(yīng)當(dāng)與醫(yī)療器械、臨床治療經(jīng)驗(yàn)緊密結(jié)合,融入疾病診療流程。目前醫(yī)用納米材料研究者的背景主要是物理、化學(xué)、材料、生物和醫(yī)學(xué),著眼于納米藥物本身,而來(lái)自數(shù)學(xué)、計(jì)算機(jī)、機(jī)械、微電子等領(lǐng)域的新鮮血液可以為開(kāi)發(fā)新型智能納米機(jī)器及其配套醫(yī)療器械、操控軟件注入活力。培養(yǎng)一批具有多學(xué)科交叉背景的學(xué)術(shù)帶頭人,協(xié)調(diào)不同背景的研究者集中突破重大科學(xué)問(wèn)題。可以預(yù)見(jiàn),未來(lái)的部分智能納米機(jī)器將實(shí)現(xiàn)納米藥物、設(shè)備硬件以及人機(jī)交互界面的集成,提供一整套臨床治療方案。
(2)構(gòu)建醫(yī)用納米技術(shù)產(chǎn)業(yè)生態(tài)圈。學(xué)習(xí)美國(guó)NCI Alliance和蘇州納米所—生物納米科技園—納米城三位一體的先進(jìn)經(jīng)驗(yàn),圍繞納米科技人才聚集地布局納米科技產(chǎn)業(yè)園,鼓勵(lì)科研成果轉(zhuǎn)讓?zhuān)尫呕A(chǔ)研究?jī)?yōu)勢(shì),促進(jìn)一批初創(chuàng)企業(yè)的快速成長(zhǎng),增加本土醫(yī)療器械與制藥企業(yè)的國(guó)際競(jìng)爭(zhēng)力。
(3)監(jiān)管機(jī)構(gòu)與納米醫(yī)藥行業(yè)從業(yè)者共同完善關(guān)于醫(yī)用納米材料產(chǎn)品的技術(shù)要求,推出指導(dǎo)原則,降低納米醫(yī)藥產(chǎn)品開(kāi)發(fā)的政策風(fēng)險(xiǎn)。
(4)推動(dòng)醫(yī)用納米材料監(jiān)管、科研和產(chǎn)業(yè)領(lǐng)域的國(guó)際交流合作。不同地區(qū)的納米醫(yī)藥開(kāi)發(fā)各有所長(zhǎng),相互學(xué)習(xí)經(jīng)驗(yàn)方法對(duì)于促進(jìn)我國(guó)醫(yī)用納米技術(shù)商業(yè)化有重要意義。
參 考 文 獻(xiàn)
[1] 總報(bào)告起草組, 李志宏. 國(guó)家應(yīng)對(duì)人口老齡化戰(zhàn)略研究總報(bào)告. 老齡科學(xué)研究, 2015, (3): 4—38.
[2] Zhou MG, Wang HD, Zeng XY, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990—2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet, 2019, 394(10204): 1145—1158.
[3] Tian YH, Li SP, Song J, et al. A doxorubicin delivery platform using engineered natural membrane vesicle exosomes for targeted tumor therapy. Biomaterials, 2014, 35(7): 2383—2390.
[4] Hu CM, Fang RH, Wang KC, et al. Nanoparticle biointerfacing by platelet membrane cloaking. Nature, 2015, 526(7571): 118—121.
[5] Schwechheimer C, Kuehn MJ. Outer-membrane vesicles from Gram-negative bacteria: biogenesis and functions. Nature Reviews Microbiology, 2015, 13(10): 605—619.
[6] Liang QL, Bie NN, Yong TY, et al. The softness of tumour-cell-derived microparticles regulates their drug-delivery efficiency. Nature Biomedical Engineering, 2019, 3(9): 729—740.
[7] Wang C, Piao JF, Li YJ, et al. Construction of liposomes mimicking cell membrane structure through frame-guided assembly. Angewandte Chemie International Edition, 2020, 59(35): 15176—15180.
[8] Li SP, Jiang Q, Liu SL, et al. A DNA nanorobot functions as a cancer therapeutic in response to a molecular trigger in vivo. Nature Biotechnology, 2018, 36(3): 258—264.
[9] Lee I, Razaghi R, Gilpatrick T, et al. Simultaneous profiling of chromatin accessibility and methylation on human cell lines with nanopore sequencing. Nature Methods, 2020, 17(12): 1191—1199.
[10] Xianyu YL, Wu J, Chen YP, et al. Controllable assembly of enzymes for multiplexed Lab-on-a-Chip bioassays with a tunable detection range. Angewandte Chemie International Edition, 2018, 57(25): 7503—7507.
[11] Yang MZ, Zhang W, Yang JC, et al. Skiving stacked sheets of paper into test paper for rapid and multiplexed assay. Science Advances, 2017, 3(12), eaao4862.
[12] Lu Y, Aimetti AA, Langer R, et al. Bioresponsive materials. Nature Reviews Materials, 2016, 2(1): 16075.
[13] Zhang WJ, Hu XL, Shen Q, et al. Mitochondria-specific drug release and reactive oxygen species burst induced by polyprodrug nanoreactors can enhance chemotherapy. Nature Communications, 2019, 10(1): 1704.
[14] Zhang LJ, Qi YQ, Min H, et al. Cooperatively responsive peptide nanotherapeutic that regulates angiopoietin receptor Tie2 activity in tumor microenvironment to prevent breast tumor relapse after chemotherapy. Acs Nano, 2019, 13(5): 5091—5102.
[15] Korin N, Kanapathipillai M, Matthews BD, et al. Shear-activated nanotherapeutics for drug targeting to obstructed blood vessels. Science, 2012, 337(6095): 738—742.
[16] Liang MM, Fan KL, Zhou M, et al. H-ferritin-nanocaged doxorubicin nanoparticles specifically target and kill tumors with a single-dose injection. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(41): 14900—14905.
[17] Yuan Y, Du C, Sun CJ, et al. Chaperonin-GroEL as a smart hydrophobic drug delivery and tumor targeting molecular machine for tumor therapy. Nano Letters, 2018, 18(2): 921—928.
[18] Zipkin M. Big pharma buys into exosomes for drug delivery. Nature Biotechnology, 2020, 38(11): 1226—1228.
[19] Felfoul O, Mohammadi M, Taherkhani S, et al. Magneto-aerotactic bacteria deliver drug-containing nanoliposomes to tumour hypoxic regions. Nature Nanotechnology, 2016, 11(11): 941—947.
[20] Eskandari SK, Sulkaj I, Melo MB, et al. Regulatory T cells engineered with TCR signaling-responsive IL-2 nanogels suppress alloimmunity in sites of antigen encounter. Science Translational Medicine, 2020, 12(569): eaaw4744.
[21] Tang L, Zheng YR, Melo MB, et al. Enhancing T cell therapy through TCR-signaling-responsive nanoparticle drug delivery. Nature Biotechnology, 2018, 36(8): 707—716.
中國(guó)-博士人才網(wǎng)發(fā)布
聲明提示:凡本網(wǎng)注明“來(lái)源:XXX”的文/圖等稿件,本網(wǎng)轉(zhuǎn)載出于傳遞更多信息及方便產(chǎn)業(yè)探討之目的,并不意味著本站贊同其觀(guān)點(diǎn)或證實(shí)其內(nèi)容的真實(shí)性,文章內(nèi)容僅供參考。





















